Dossier sur la perméabilité intestinale et son intérêt en matière de santé
- Hugo Desbouis

- 16 oct.
- 30 min de lecture
La maxime « toutes les maladies commencent dans l’intestin » aurait, d’après la légende, été popularisé il y a environ 2000 ans par Hippocrate, père de la médecine moderne. Bien que cette citation n’ait jamais été authentifié, elle démontre l’importance et le rôle historique de l’intestin et de la sphère digestive en matière de santé.
Plus récemment, c’est l’un des plus grands gastro-entérologue au monde et spécialiste de la maladie cœliaque qui reprenait cette citation pour en faire le titre d’un de ses articles scientifiques (1). De manière plus globale, la sphère digestive constitue un champ de recherche en pleine expansion depuis le début du 21ème siècle.
Que ce soit via les notions de microbiote, d’hyperperméabilité intestinale ou encore de sensibilité/intolérance au gluten, on se rend de plus en plus compte à quel point l’appareil digestif au sens large occupe une place prépondérante en matière de santé.
Dans cet article, je vous propose donc de plonger en détail dans le fonctionnement de l’appareil digestif et de l’intestin grêle, puis d’explorer en détail le mécanisme d’hyperperméabilité intestinale et la manière dont celui-ci peut être impliqué dans la survenue de nombreuses pathologies.
1. Un peu de physiologie et d’anatomie : comprendre l’intestin grêle
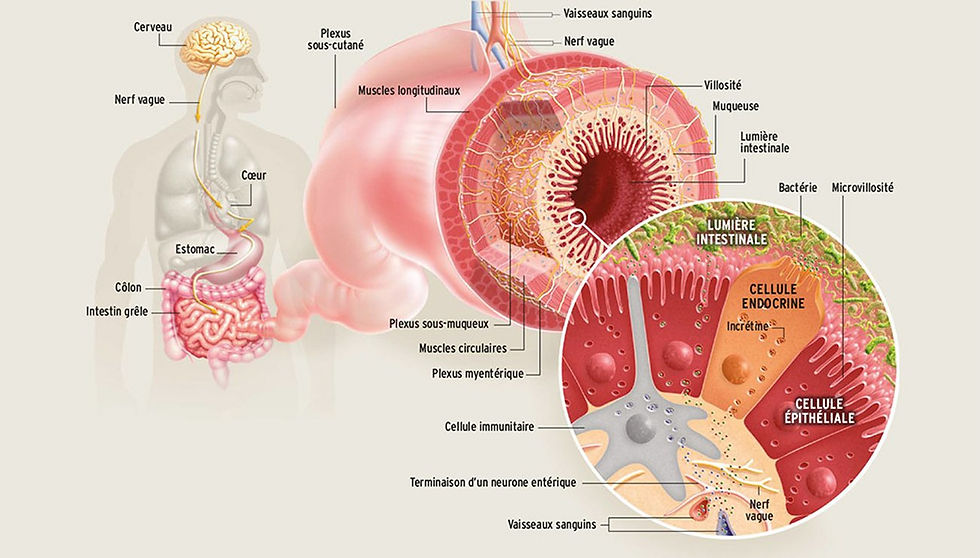
Avant de se concentrer sur le rôle de l’intestin grêle en matière de digestion, revenons d’abord sur le système digestif dans son intégralité. Il comprend ainsi la bouche, la gorge, l’œsophage, l’estomac, l’intestin grêle, le gros intestin ou colon, le rectum et l’anus. A ces organes, il convient d’ajouter le pancréas, le foie, la vésicule biliaire et les glandes salivaires, qui possèdent également des rôles importants dans le processus de digestion (cf. schéma ci-dessous). Dans son ensemble, le système digestif permet l’ingestion de nourriture, sa dégradation en nutriments, l’absorption des nutriments dans le sang et enfin l’élimination de l’organisme des éléments indigestes.

En ce qui nous concerne, nous allons nous attardons sur les rôles fondamentaux que possède l’intestin grêle. Situé entre l’estomac et le gros intestin, il permet dans un 1er temps d’absorber une bonne partie des nutriments en provenance de l’estomac. Cette absorption se fait principalement au niveau du duodénum et du jéjunum, les 2 premières parties de l’intestin grêle après l’estomac.

Mais l’intestin grêle assure également une 2ème fonction fondamentale : empêcher le passage dans le sang de molécules indésirables (bactéries, virus, protéines etc…). Cela est rendu possible par une structure que l’on appelle la muqueuse intestinale ; cette muqueuse fait en effet office de barrière entre le système digestif et le sang. En quelque sorte, on pourrait considérer le système digestif comme l’extérieur et le sang comme l’intérieur, ceci rendant compte de l’importance de la barrière intestinale. Cette barrière intestinale est constituée de cellules épithéliales spécialisées, que l’on appelle les entérocytes (cf. figure N°3). Ces entérocytes permettent le passage dans le sang de certains nutriments et certaines substances via un mécanisme appelé diffusion transcellulaire.
Cette diffusion transcellulaire permet notamment l’absorption des acides aminés, de certains glucides, des acides gras à chaînes courtes ou encore de certains micronutriments. C’est une voie finement régulée et dépendant de transporteurs spécifiques situés sur la membrane des entérocytes.
Entre chacun des entérocytes, on retrouve également un petit espace appelé jonction serré, et qui garantit en temps normal la perméabilité sélective de l’intestin grêle, c’est-à-dire le passage dans le sang d’un nombre restreint de molécules (cf. figure N°4). Ces jonctions serrées sont le lieu d’un autre type d’absorption, non plus transcellulaire mais cette fois paracellulaire. Des molécules de petite taille comme l’eau, les acides gras à chaînes courtes et certains ions (sodium, potassium) peuvent notamment passer au travers de ces jonctions, la ou des molécules de plus grosses tailles sont normalement dans l’incapacité de franchir ces jonctions. Le fonctionnement de ces jonctions serrées est régulée par de nombreuses structures et protéines. Nous y reviendrons plus tard car cela s’avère fondamental dans le processus d’hyperperméabilité intestinale.
Précisons enfin que la barrière intestinale est une structure complexe, ou l’on retrouve également de nombreuses bactéries, notamment celles issues du microbiote. On retrouve également une couche de mucus qui permet l’hydratation et la protection des cellules épithéliales. Enfin, la présence de nombreuses cellules de l’immunité, constituant ce que l’on appelle le tissu lymphoïde associé à l’intestin (GALT), fait de l’intestin grêle un élément crucial en matière d’immunité.

2. L’hyperperméabilité (HPI) : physiopathologie et conséquences
Comme évoqué dans la partie précédente, la perméabilité sélective et contrôlée de l’intestin grêle est un phénomène ô combien important et finement régulé. Cette perméabilité est notamment associée à la présence de jonctions serrées, l’espace qui figure entre deux cellules épithéliales (les entérocytes) de l’intestin grêle. La structure de ces jonctions serrées est contrôlée et régulée par plusieurs protéines différentes, parmi lesquelles on retrouve les claudines, les occludines, les JAM (Junctional Adhesion Molecules) ou encore les zonula occludens (ZO-1, ZO-2 et ZO-3).
Comme beaucoup de phénomènes biologiques (le stress, l’inflammation etc..), la perméabilité intestinale peut être momentanée augmentée et ne poser aucun problème en matière de santé. Elle devient problématique lorsqu’elle est excessive et surtout prolongée dans le temps.
En effet, cette perméabilité intestinale accrue permet le passage dans le sang de molécules qui n’ont rien à y faire et qui sont reconnues par le corps comme des antigènes. Parmi les antigènes les plus fréquents dans le cadre de l’HPI, on retrouve notamment des fragments de protéines partiellement digérés, comme la gliadine issue du gluten ou encore la caséine issue du lait. Ces 2 protéines sont en effet particulièrement résistantes aux enzymes digestives, notamment pour ce qui est de la gliadine (2), du fait de sa teneur élevée en proline et en glutamine (3). La teneur élevée en proline de la caséine rend également sa digestion complexe (4). Des peptides (fragments de protéines) peuvent ainsi atteindre la muqueuse intestinale et augmenter la perméabilité intestinale chez les personnes sensibles. On peut également mentionner les lipopolysaccharides (LPS) issus de certaines bactéries à gram négatives, qui sont des endotoxines susceptibles de générer une réponse inflammatoire systémique ; c’est ce qu’on appelle la translocation bactérienne. Ces LPS proviennent notamment de certaines bactéries du microbiote présentes dans la lumière intestinale, et qui, en cas de perméabilité intestinale accrue, peuvent se retrouver dans la circulation sanguine (5). Elles peuvent ainsi déclencher une inflammation systémique via un processus appelé endotoxémie de bas grade (6). A noter qu’en temps normal, les LPS présents dans la circulation sanguine peuvent être dégradés par des enzymes hépatiques (alcaline phosphatase et acyloxyacyl hydroxylase) et éliminés par la vésicule biliaire (cf. figure N°5) (7).

Il existe qui plus est une autre protéine fondamentale dans le phénomène d’HPI ; la zonuline. Cette protéine, récemment découverte à l’échelle de la science, permet lorsqu’elle est secrétée de désassembler les protéines de structure des jonctions serrées comme les claudines et les occludines. Cela entraine une augmentation temporaire de la perméabilité intestinale, phénomène connu sous l’appellation anglaise de « leaky gut syndrom ».
Nous verrons plus tard quels sont les facteurs qui contribuent à l’instauration de ce « leaky gut syndrom ».
Voyons avant cela les conséquences de l’HPI en matière de santé humaine et, vous allez le voir, elles sont plutôt nombreuses.
HPI et maladies auto-immunes :
De nombreuses études mettent en avant le rôle de l’HPI dans la survenue de maladies auto-immunes. A ce jour, il est encore difficile de dire si l’HPI est une cause ou une conséquence (ou les 2) des maladies auto-immunes. Toutefois, l’HPI, en favorisant le passage dans le sang de peptides alimentaires partiellement digérés, pourrait déclencher une forme d’auto-immunité chez les personnes génétiquement prédisposées (8). Cela semble notamment le cas en ce qui concerne le diabète de type 1 (9), la polyarthrite rhumatoïde (10), la sclérose en plaques (11), la maladie cœliaque (12), la maladie de Crohn (12) ou encore l’hypothyroïdie de Hashimoto (13).
Encore une fois, attention à ne pas pour autant tomber dans le sensationnalisme. Oui l’HPI semble être une composante importante de l’auto-immunité, mais elle n’explique pas tout pour autant.
HPI et perturbations métaboliques :
En ce qui concerne la « santé métabolique », il semblerait que l’HPI puisse jouer la aussi un rôle significatif. Cela semble particulièrement vrai dans le cadre de l’endotoxémie de bas grade dont nous parlions précédemment. Celle-ci est en effet associée à une augmentation de l’inflammation et du stress oxydatif. Par le biais de ces deux processus, l’endotoxémie serait ainsi à même d’instaurer une résistance à l’insuline (14)(15). La perméabilité intestinale semble qui plus est corrélée au degré de stéatose hépatique constaté chez des patients en situation d’obésité (16). Chez des patients en situation de surpoids, une méta-analyse (17) regroupant 17 études a montré que la perte de poids chez ces patients était associée à une diminution des marqueurs de perméabilité intestinale, quels que soient ceux utilisés (zonuline fécale/sanguine, LBP, LPS ou ratio lactulose/mannitol). Une étude de 2012 (18), effectuée sur 123 hommes de type caucasiens, confirme ces résultats ; elle montre une augmentation des valeurs de zonuline en fonction de l’indice de masse corporelle (IMC) et de l’insulinémie, mettant également en avant le rôle crucial de l’interleukine-6 (IL-6) dans l’ensemble de ces perturbations métaboliques. Or, il est désormais admis au sein de la communauté scientifique que le surpoids et l’obésité sont associés à une augmentation de la production d’adipokines, c’est-à-dire de cytokines pro-inflammatoires comme l’IL-6 relâchées par le tissu adipeux (19)(20).
HPI et maladies cardio-vasculaires :
L’HPI étant un potentiel déclencheur d’inflammation systémique à bas bruit, il est n’est pas étonnant qu’elle soit associée à un risque accru de maladies cardio-vasculaires (MCV). En effet, l’inflammation joue un rôle crucial dans la mise en place du processus athérosclérotique à l’origine de nombreux AVC et infarctus du myocarde.
C’est la conclusion à laquelle est ainsi parvenue une revue systématique et une méta-analyse chinoise (21) de 2024 ; au sein de cette étude, 13 travaux étaient regroupés, pour un total de 1321 patients pour la plupart âgés de plus de 48 ans. Les chercheurs ont constaté que la perméabilité intestinale était significativement plus élevée chez les sujets atteints de troubles cardio-vasculaires que chez les sujets sains. Ces résultats semblent qui plus est confirmés par une autre étude très récente et datant de juillet 2025 (22).
Il est encore trop tôt cependant pour affirmer que l’HPI puisse constituer un élément prédictif et fiable de la survenue de MCV. Toutefois, les liens physiologiques ne sont d’ores et déjà plus à établir.
HPI et risques de cancers (colorectaux principalement) :
L’HPI semblerait également associée à une augmentation du risque de cancers colorectaux. C’est déjà ce que démontrait une étude de 1999 effectuée sur des modèles animaux (23). Depuis, on retrouve plusieurs travaux qui mentionnent clairement un lien entre l’altération de la muqueuse intestinale et l’augmentation des risques de développer un cancer colo-rectal (24)(25). Cette relation serait fortement médiée par l’intervention du microbiote intestinal (26), dont je parle dans un autre de mes articles.
3. Comment diagnostiquer l’HPI
Dans cette partie, nous allons voir que l’HPI est un phénomène complexe à évaluer en biologie de routine. Pour autant, elle n’en demeure pas moins un phénomène très étudié puisqu’à ce jour, on retrouve sur PubMed près de 30 000 références scientifiques à ce sujet.
Dans les études, la méthode dite « gold standard », comprenez « méthode de référence », est ce qu’on appelle la technique lactulose/mannitol (27). Elle consiste à faire ingérer aux patients une solution contenant deux types de sucre : un disaccharide de grande taille (le lactulose) et normalement absorbé par voie paracellulaire au niveau de l’intestin grêle et un monosaccharide plus petit et normalement absorbé par voie transcellulaire (le mannitol). Si la barrière intestinale est endommagée et la perméabilité intestinale augmentée, on retrouvera des valeurs élevées de lactulose dans les urines et une augmentation du ratio lactulose/mannitol. Bien que très fiable, ce test est malheureusement très compliqué à implémenter en pratique courante du fait de sa complexité.
Un autre test fréquemment utilisé est la mesure de la zonuline, protéine de régulation de la perméabilité intestinale que nous avons mentionnée tout à l’heure. Cette mesure peut se faire dans le sang ou dans les selles dépendant des laboratoires. La plupart de ces derniers la propose dans leur « catalogue » de tests, bien qu’elle ne soit évidemment pas remboursée. En ce qui concerne la zonuline sanguine, celle-ci ne montre malheureusement pas une bonne corrélation avec le test lactulose-mannitol (28)(29). Il semblerait ainsi que les méthodes de détection actuelles n’identifient pas la bonne molécule ; alors que la zonuline correspond à une protéine appelée prehaptoglobine-2, les méthodes actuelles détecteraient enfaite des protéines de la même famille mais néanmoins différentes comme la properdine ou l’haptoglobine (30). Toujours est-il qu’à l’heure actuelle, la zonuline sanguine ne constitue probablement pas un marqueur fiable de la perméabilité intestinale.
En ce qui concerne la zonuline fécale, celle-ci montre une bonne corrélation avec le test de référence lactulose/mannitol, mais uniquement chez les personnes en situation de surpoids ou d’obésité (31). Cependant, le recueil d’un échantillon de selles peut à lui tout seul s’avérer un problème, et ce pour un bon nombre de patients. Par conséquent, la zonuline fécale ne semble pas non plus constituer un marqueur pertinent de perméabilité intestinale.
A ce jour, le marqueur d’HPI qui s’avère le plus prometteur est probablement la LBP (lipopolysaccharide binding protein). La LBP est une protéine produite par le foie et se lie aux LPS produits par les bactéries à Gram négatif afin que ces LPS puissent circuler dans le sang. La LBP joue un rôle clé puisqu’elle permet de présenter les LPS aux cellules immunitaires que sont par exemple les CD14 ou les TLR4. Le principal problème de la LBP est qu’elle peut manquer de spécificité ; en plus d’être un marqueur de perméabilité intestinale, elle peut également augmenter en cas d’infection bactérienne récente. Pour autant, elle s’avère très pratique et simple à mesure puisqu’elle ne requiert qu’une prise de sang classique. Qui plus est, la LBP s’avère très fortement corrélée aux résultats obtenus avec le test lactulose/mannitol et ce au sein de plusieurs travaux scientifiques (31)(32). Finalement, le « seul » problème du LBP est son manque de spécificité et le manque de recul que l’on peut encore avoir à son sujet. Il n’en demeure pas moins un marqueur pertinent et très utile en pratique.
La calprotectine fécale est souvent mentionnée comme pertinente dans l’évaluation de la santé intestinale. Elle l’est effectivement, mais plutôt pour ce qui est de mesurer l’état d’inflammation de la muqueuse intestinale et non son degré de perméabilité. Elle est ainsi utilisée pour diagnostiquer/confirmer la présence de pathologies inflammatoires de l’intestin comme la maladie de Crohn ou la rectocolite hémorragique (33)(34).
Enfin, évoquons un autre test, là encore (potentiellement) très prometteur en matière de perméabilité intestinale : le I-FABP (intestinal – fatty acid binding protein). Cette protéine est retrouvée principalement dans les entérocytes matures de l’intestin grêle. Elle est relâchée dans la circulation sanguine lorsque les entérocytes subissent un dommage quelconque. Certaines études mettent ainsi en avant une corrélation entre les taux de I-FABP dans le sang et la sévérité du psoriasis (35) ou du diabète de type 2 (36) constatés chez les patients. Pour autant, une étude déjà mentionnée (31) ne retrouve pas de corrélations très significatives entre les valeurs sanguines de I-FAPB et les résultats du test lactulose-mannitol.
Comme nous pouvons le voir, il n’existe pas à ce jour de moyen parfait pour mesurer la perméabilité intestinale. Alors que le test lactulose/mannitol se place comme la méthode la plus précise, son côté contraignant ne permet malheureusement pas un usage à grande échelle en tant qu’outil de biologie courante.
Le LBP et le I-FABP émergent donc comme les deux marqueurs les plus fiables et les plus pratiques au quotidien. Pour autant, ils ne sont pas 100% spécifiques à la perméabilité intestinale et il conviendra donc de les utiliser en ayant au préalable éliminé des facteurs comme les infections bactériennes.
Comme d’habitude, l’usage de ces tests, pour demeurer suffisamment fiable et pertinent, devra se faire au regard du tableau clinique global du patient et en ayant pris le soin d’identifier d’éventuels symptômes qui pourraient faire penser à une situation d’HPI. Pour cela, on pourra notamment se référer au questionnaire de vulnérabilité digestive proposé par l’institut européen de diététique et de micronutrition, et dont une version peut être trouvée sur internet.
4. Les facteurs qui contribuent à l’HPI
Après avoir vu ce qu’était l’HPI et comment la diagnostiquer, tant sur le plan clinique sur le plan biologique, rentrons dans ce qui vous intéresse probablement le plus : qu’est ce qui déclenche l’HPI et comment, au contraire, s’en prémunir ?
Il existe (malheureusement) une longue liste d’éléments qui peuvent endommager la structure de l’intestin grêle et ainsi induire un état d’hyperperméabilité intestinale.
Celui par lequel je vais commencer et qui est probablement l’un des plus connus est le stress psychologique/émotionnel. Bien que le stress ne soit généralement pas un problème lorsque transitoire, une forte période de stress psychologique/émotionnel est bien souvent retrouvée juste avant le déclenchement de troubles auto-immuns. L’augmentation de la perméabilité intestinale suite à un épisode de stress s’expliquerait notamment par l’activation du système hypothalamo-hypophyso-surrénalien et la production d’hormones comme le cortisol ou la CRH (37)(38). Il y a fort à parier cependant que l’intensité de ce mécanisme varie en fonction des individus. De plus, le lien entre stress et HPI est clairement établi chez l’animal mais demande encore à être démontré de façon consensuelle chez l’humain (39).
Pour continuer sur la question, passons plutôt sur un stress environnemental/physique. En effet, il faut savoir que l’activité physique en endurance à haute intensité et/ou prolongée est également susceptible d’augmenter la perméabilité intestinale (40)(41)(42). Cela semble surtout être le cas chez des athlètes s’entrainant beaucoup, situation ou la muqueuse intestinale n’a pas le temps de bien se régénérer entre chaque entrainements. Cette HPI pourrait qui plus est être augmentée par des facteurs environnementaux tels que la chaleur et la déshydratation. A tous les sportifs d’endurance, faites très attention à votre santé lors d’entrainements longs, intenses et pratiqués en conditions chaudes.
On s’éloigne maintenant de la pratique sportive (quoique) pour revenir à des aspects plus « classiques ». En 1er lieu, abordons la question de l’alcool ; de nombreux travaux montrent ainsi que la consommation d’alcool (aigue ou chronique) augmente la perméabilité intestinale en dérégulation l’expression et le fonctionnement des claudines, des occludines et des ZO-1 (43)(44). Sans parler de l’impact de la consommation d’alcool sur la composition du microbiote et sur l’inflammation intestinale. Si vous souhaitez prendre soin de vos intestins et de votre santé, vous avez ainsi à tout intérêt à réduire votre consommation d’alcool autant que possible. Jusque là rien de nouveau me direz-vous 😊 Il en va de même pour le tabac, ou de nombreux articles mettent en avant que le fait de fumer entraine une augmentation de la perméabilité intestinale (45).
Au-delà de la consommation d’alcool et de cigarette, l’inflammation de bas grade pourrait elle aussi être en mesure de perturber la perméabilité intestinale, notamment à cause de la production de cytokines pro-inflammatoires comme l’IL-6 ou le TNF-α. Chez les personnes victimes de maladies inflammatoires de l’intestin, on retrouve en effet systématiquement une augmentation de la perméabilité intestinale via une dérégulation des protéines impliquées dans la structure des jonctions serrées (46)(47). Sur des modèles animaux, il a été montré qu’un traitement de 24h par des cytokines pro-inflammatoires telle que le TNF-α augmentait considérablement la perméabilité intestinale (48). Chez l’humain, une étude de 2024 (49) met en évidence une corrélation étroite entre les valeurs de protéine-C réactive et les valeurs de LBP (r = 0.78; β = 0.57; P < 0.0001). Ces résultats semblent confirmés par d’autres travaux (50), bien que dans cette dernière étude l’utilisation de la zonuline comme marqueur de HPI fasse planer un doute sur la fiabilité des résultats. Au global, il semble bel et bien qu’il y ait une relation étroite entre inflammation et HPI, bien que cette relation puisse être bidirectionnelle et demande à être clarifiée.
En ce qui concerne la dysbiose intestinale et l’impact de celle-ci sur la perméabilité intestinale, la encore les résultats semblent clairs. La dysbiose engendre en effet une réduction de la production d’acides gras à chaînes courtes aux effets anti-inflammatoires sur la muqueuse intestinale. Elle augmente donc l’inflammation sur cette même muqueuse et, comme nous l’avons vu, l’inflammation de la muqueuse est très probablement liée à une augmentation de la perméabilité intestinale ! Ce lien entre dysbiose et HPI, la encore probablement réciproque, est démontré dans de très nombreux travaux et de manière quasi consensuelle (51)(52)(53).
Au niveau alimentaire, de nombreux paramètres peuvent influencer la bonne santé de l’intestin grêle et la perméabilité intestinale associée.
Dans un 1er temps, il semblerait que la consommation d’oméga-3 puisse exercer un effet bénéfique sur la fonction intestinale (54), la perméabilité associée (55) ainsi que la production d’acides gras à chaîne courte par le microbiote (56)(57). En ce qui concerne les acides gras saturés (AGS), particulièrement ceux à chaînes longues comme l’acide stéarique ou palmitique, une consommation importante pourrait augmenter la perméabilité intestinale (58)(59). Il semblerait, de manière plus généralisée, qu’une diète riche en acides gras saturés/trans puisse engendrer des modifications dans la composition du microbiote et ainsi induire une inflammation de la muqueuse intestinale et de l’HPI (60).
En ce qui concerne les protéines, peu/pas d’études effectuées chez l’humain permettent à ce jour de conclure à l’impact de la teneur alimentaires en protéines sur la perméabilité intestinale.
Un apport faible en fibres est quant à lui clairement associé à une augmentation de la perméabilité intestinale, notamment via un impact sur la composition du microbiote et sur la couche de mucus qui protège en temps normal les cellules épithéliales de l’intestin grêle (61). De plus, un faible apport de fibres réduit la production d’acides gras à chaînes courtes issus de certaines bactéries, augmentant encore la fragilité de la muqueuse intestinale (62).
Enfin, abordons rapidement la question des médicaments et des antibiotiques : concernant ces derniers, il est désormais couramment admis que les antibiotiques à spectre large engendrent une réduction de la diversité microbienne et, par conséquent, une augmentation de la perméabilité intestinale (63)(64). Pour ce qui est des médicaments, nombre d’entre eux sont également associés à une réduction de la diversité microbienne (65) et donc à de potentiels dommages en ce qui concerne la muqueuse intestinale, notamment en ce qui concerne l’aspirine et les autres anti-inflammatoires non-stéroïdiens (66)(67).
5. Les facteurs qui préviennent/soignent l’HPI
Après avoir évoqué les facteurs qui augmentent la perméabilité intestinale et endommagent la fonction digestive dans son ensemble, voyons désormais ceux qui contribuent à la bonne santé digestive et au renforcement de la barrière intestinale.
Tout d’abord, il y a fort à parier que la consommation de fibres en quantité suffisante (directement dans l’alimentation ou via une supplémentation) améliore la fonction digestive et réduise la perméabilité intestinale, bien que nous manquions de preuves solides à ce jour chez l’humain. Chez des patients malades et hospitalisés, une méta-analyse de 21 études (68) a montré qu’une supplémentation en fibres permettait d’augmenter le nombre de bactéries du microbiote, de réduire les niveaux de protéine C réactive ainsi que la durée des séjours à l’hôpital et la mortalité globale. Chez des patients atteints de stéatose hépatique, une augmentation de l’apport en fibres de 19 à 29gr/jour pendant 6 mois a permis de faire baisser les valeurs de zonuline dans le sang (69). L’absence de groupe contrôle et l’utilisation de la zonuline dans le sérum comme marqueur de HPI rendent toutefois ces résultats fragiles. Chez l’humain, une méta-analyse (70) de 2018 nous apprend qu’une consommation importante de fibres est associée à une augmentation du nombre de bactéries fécales de type lactobacillus ou bifidobactérium, 2 familles de bactéries aux effets généralement positifs en matière de santé. Toutefois, cette étude ne nous dit pas si cet apport accru en fibres possède un impact favorable sur la perméabilité intestinale, bien que nous puissions fortement le supposer.
Maintenant que nous avons évoqué les prébiotiques (= les fibres), abordons la question des probiotiques. Dans ce cas de figure, les effets sur la perméabilité intestinale semblent clairement démontrés ; une 1ère méta-analyse (71) de 2023, regroupant 26 essais randomisés et 1900 patients, met en évidence un clair bénéfice de la consommation de probiotiques sur les marqueurs de perméabilité intestinale (zonuline, endotoxines et LPS) ainsi que sur la réduction des marqueurs inflammatoires comme l’IL-6, la CRP ou le TNF-α. Une autre méta-analyse (72) regroupant cette fois 12 études chez l’animal et 14 essais cliniques chez l’humain, semble confirmer ces résultats. La consommation de probiotiques a en effet réduit la perméabilité intestinale dans 11 des 12 études effectuées chez l’animal alors que, pour l’humain, des bénéfices significatifs étaient retrouvés dans la moitié des essais. A noter que l’on retrouvait parmi ces essais une grande diversité de méthodologies ; cela tend à démontrer que la durée de supplémentation et le type de souches utilisées déterminent probablement en grande partie les effets des probiotiques sur la perméabilité intestinale. Ceci étant dit, la consommation de probiotiques semble clairement efficace et pertinente en cas de perméabilité intestinale accrue.
En ce qui concerne les acides gras, il se pourrait que la supplémentation en oméga-3 ait un impact positif sur la perméabilité intestinale (55), bien que des résultats complémentaires soient requis afin de pouvoir tirer des conclusions à ce sujet. Il en va probablement de même pour la supplémentation en acides gras à chaînes courtes (SCFA), pour lesquels plusieurs études chez l’animaux et sur des modèles cellulaires in vitro mettent en avant une diminution de la perméabilité intestinale (73)(74)(75). A noter que la production de SCFA (acétate, propionate, butyrate) dépend principalement de l’apport en fibres et de la fermentation de ces dernières par les bactéries du colon, principalement les firmicutes et les bactéroidetes (76). Ainsi, une barrière intestinale solide et efficace passe également par un microbiote de qualité.
Pour ce qui est des autres compléments alimentaires, retenez que certains d’entre eux pourraient avoir une efficacité mais que la plupart ont été étudiés sur des modèles animaux. Pour ce qui est de la glutamine, son efficacité semble surtout constatée à très hautes doses (77) (>30gr/jour) et dans le cadre de personnes souffrant d’une très forte perméabilité intestinale (personnes brulées, malades etc.). En ce qui concerne les autres compléments, il se pourrait que la vitamine A, la vitamine D, la curcumine, la berbérine, le resvératrol ou encore la quercétine aient des effets positifs sur la perméabilité intestinale (78). A ce jour, trop peu d’études existent cependant chez l’humain afin de pouvoir tirer des conclusions. L’efficacité de ces compléments pourrait aussi dépendre du statut biologique initial de la personne, notamment concernant les vitamines liposolubles A et D.
Cela va sans dire que, pour soigner un leaky gut, il conviendra également de supprimer l’alcool, les antibiotiques, la plupart des médicaments (sauf en cas de nécessité, BIEN ENTENDU) et la cigarette et de faire en sorte de contrôler/modérer les épisodes de stress. L’inflammation de bas grade devra également être limitée car celle-ci pourrait posséder un impact négatif sur la barrière intestinale du grêle.
Enfin, parlons du rôle de l’activité physique en matière de perméabilité intestinale. La ou les efforts d’endurance à haute intensité/haut volume ont tendance à augmenter la perméabilité intestinale, il faut savoir que les mêmes efforts d’endurance mais de durées et d’intensités modérées auront plutôt tendance à avoir un impact positif sur la muqueuse intestinale (79)(80), bien que cela ait principalement été démontré sur des modèles animaux. Chez l’humain, il a été démontré (81) qu’un programme d’endurance de 6 semaine conduit auprès de 17 femmes en situation d’obésité (IMC moyen de 31) permettait une amélioration du microbiote, notamment via une augmentation du nombre de bactéries de type Akkermansia. Une méta-analyse de 2024 et regroupant 25 études (82) nous apprend également que la pratique d’une activité physique régulière augmente la diversité microbienne, expliquant ainsi potentiellement les effets positifs de la pratique d’une activité physique sur la santé cardio-vasculaire, métabolique et mentale. Malheureusement, il est pour l’heure difficile d’affirmer que l’entrainement en résistance ou en endurance est plus efficace en ce qui concerne la diversité microbienne et la perméabilité intestinale.
6. Conclusion
En conclusion de ce long article, rappelons à quel point le système digestif est important en matière de santé. En l’occurrence, il faut garder en tête que l’intestin grêle possède 2 fonctions majeures au sein de l’organisme : absorber les nutriments et empêcher le passage dans le sang de molécules indésirables. Ainsi, garantir son étanchéité et son intégrité s’avère fondamental.
Pour cela, on veillera à limiter autant que possible les forts épisodes de stress, la consommation d’alcool, de tabac, de médicaments/antibiotiques et de graisses saturées/trans en grande quantité. On misera plutôt sur une consommation importante de fibres et une consommation suffisante de protéines et d’acides gras-oméga-3. Pour certaines personnes, la consommation de gluten et/ou de caséines issues du lait de vache pourra s’avérer pertinente et à essayer. La supplémentation en probiotiques semble qui plus très pertinente en matière de perméabilité intestinale. On pourra également mentionner des compléments comme la quercétine, la berbérine, la vitamine D ou encore le resvératrol mais nous manquons d’études chez l’humain pour le moment.
En ce qui concerne l’activité physique, il faudra prioriser des activités modérées, aussi bien en termes de durée que d’intensité. Si vous souhaitez prendre soin de vos intestins, limitez donc autant que possible les sports d’endurance à haut volume/haute intensité. Misez plutôt sur du renforcement, combiné idéalement à de l’endurance.
Pour autant et pour finir, gardons en tête que la plupart des études sur la perméabilité intestinale sont à ce jour effectuées chez l’animal ou sur des modèles cellulaires. Il convient donc de rester prudent avant de tirer des conclusions hâtives. Toutefois, libre à chacun de tester des choses si celles-ci sont reconnues comme inoffensives. Et bien sûr, l’idéal reste de se faire accompagner par quelqu’un de formé et de compétent sur ce sujet !
7. Références scientifiques
(1) Fasano A. (2020). All disease begins in the (leaky) gut: role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Research, 9, F1000 Faculty Rev-69. https://doi.org/10.12688/f1000research.20510.1
(2) Herrera, M., & Dodero, V. (2021). Gliadin proteolytical resistant peptides: the interplay between structure and self-assembly in gluten-related disorders. Biophysical Reviews, 13, 1147 - 1154. https://doi.org/10.1007/s12551-021-00856-z.
(3) Gutiérrez, S., Pérez-Andrés, J., Martínez-Blanco, H., Ferrero, M. A., Vaquero, L., Vivas, S., Casqueiro, J., & Rodríguez-Aparicio, L. B. (2017). The human digestive tract has proteases capable of gluten hydrolysis. Molecular metabolism, 6(7), 693–702. https://doi.org/10.1016/j.molmet.2017.05.008
(4) Vivanco-Maroto, S., Santos-Hernández, M., Sanchón, J., Picariello, G., Recio, I., & Miralles, B. (2022). In vitro digestion of milk proteins including intestinal brush border membrane peptidases. Transepithelial transport of resistant casein domains.. Food research international, 157, 111238 . https://doi.org/10.1016/j.foodres.2022.111238.
(5) Mohammad, S., & Thiemermann, C. (2021). Role of Metabolic Endotoxemia in Systemic Inflammation and Potential Interventions. Frontiers in Immunology, 11. https://doi.org/10.3389/fimmu.2020.594150.
(6) Violi, F., Cammisotto, V., Bartimoccia, S., Pignatelli, P., Carnevale, R., & Nocella, C. (2023). Gut-derived low-grade endotoxaemia, atherothrombosis and cardiovascular disease. Nature reviews. Cardiology, 20(1), 24–37. https://doi.org/10.1038/s41569-022-00737-2
(7) Mathilde Guerville, Gaëlle Boudry. Gastro-intestinal and hepatic mechanisms limiting the entry and dissemination of lipopolysaccharide into the systemic circulation. AJP - Gastrointestinal and Liver Physiology, 2016, 311 (1)
(8) Mu, Q., Kirby, J., Reilly, C., & Luo, X. (2017). Leaky Gut As a Danger Signal for Autoimmune Diseases. Frontiers in Immunology, 8. https://doi.org/10.3389/fimmu.2017.00598.
(9) Sorini, C., Cosorich, I., Lo Conte, M., De Giorgi, L., Facciotti, F., Lucianò, R., Rocchi, M., Ferrarese, R., Sanvito, F., Canducci, F., & Falcone, M. (2019). Loss of gut barrier integrity triggers activation of islet-reactive T cells and autoimmune diabetes. Proceedings of the National Academy of Sciences of the United States of America, 116, 15140 - 15149. https://doi.org/10.1073/pnas.1814558116.
(10) Brandl, C., Bucci, L., Schett, G., & Zaiss, M. M. (2021). Crossing the barriers: Revisiting the gut feeling in rheumatoid arthritis. European journal of immunology, 51(4), 798–810. https://doi.org/10.1002/eji.202048876
(11) Buscarinu, M., Fornasiero, A., Romano, S., Ferraldeschi, M., Mechelli, R., Reniè, R., Morena, E., Romano, C., Pellicciari, G., Landi, A., Salvetti, M., & Ristori, G. (2019). The Contribution of Gut Barrier Changes to Multiple Sclerosis Pathophysiology. Frontiers in Immunology, 10. https://doi.org/10.3389/fimmu.2019.01916.
(12) Pearson, A. D., Eastham, E. J., Laker, M. F., Craft, A. W., & Nelson, R. (1982). Intestinal permeability in children with Crohn's disease and coeliac disease. British medical journal (Clinical research ed.), 285(6334), 20–21. https://doi.org/10.1136/bmj.285.6334.20
(13) Cayres, L., De Salis, L., Rodrigues, G., Lengert, A., Biondi, A., Sargentini, L., Brisotti, J., Gomes, E., & De Oliveira, G. (2021). Detection of Alterations in the Gut Microbiota and Intestinal Permeability in Patients With Hashimoto Thyroiditis. Frontiers in Immunology, 12. https://doi.org/10.3389/fimmu.2021.579140.
(14) Cani, P., Amar, J., Iglesias, M., Poggi, M., Knauf, C., Bastelica, D., Neyrinck, A., Fava, F., Tuohy, K., Chabo, C., Waget, A., Delmée, E., Cousin, B., Sulpice, T., Chamontin, B., Ferrières, J., Tanti, J., Gibson, G., Casteilla, L., Delzenne, N., Alessi, M., & Burcelin, R. (2007). Metabolic Endotoxemia Initiates Obesity and Insulin Resistance. Diabetes, 56, 1761 - 1772. https://doi.org/10.2337/db06-1491.
(15) Rorato, R., Borges, B., Uchôa, E., Antunes-Rodrigues, J., Elias, C., & Elias, L. (2017). LPS-Induced Low-Grade Inflammation Increases Hypothalamic JNK Expression and Causes Central Insulin Resistance Irrespective of Body Weight Changes. International Journal of Molecular Sciences, 18. https://doi.org/10.3390/ijms18071431.
(16) Damms-Machado, A., Louis, S., Volynets, V., Rings, A., Basrai, M., & Bischoff, S. (2016). Gut permeability is related to body weight, fatty liver disease, and insulin resistance in obese individuals undergoing weight reduction.. The American journal of clinical nutrition, 105 1, 127-135 . https://doi.org/10.3945/ajcn.116.131110.
(17) Koutoukidis, D. A., Jebb, S. A., Zimmerman, M., Otunla, A., Henry, J. A., Ferrey, A., Schofield, E., Kinton, J., Aveyard, P., & Marchesi, J. R. (2022). The association of weight loss with changes in the gut microbiota diversity, composition, and intestinal permeability: a systematic review and meta-analysis. Gut microbes, 14(1), 2020068. https://doi.org/10.1080/19490976.2021.2020068
(18) Moreno-Navarrete, J., Sabater, M., Ortega, F., Ricart, W., & Fernández-Real, J. (2012). Circulating Zonulin, a Marker of Intestinal Permeability, Is Increased in Association with Obesity-Associated Insulin Resistance. PLoS ONE, 7. https://doi.org/10.1371/journal.pone.0037160.
(19) Éder, K., Baffy, N., Falus, A., & Fulop, A. (2009). The major inflammatory mediator interleukin-6 and obesity. Inflammation Research, 58, 727-736. https://doi.org/10.1007/s00011-009-0060-4.
(20) Sindhu, S., Thomas, R., Shihab, P., Sriraman, D., Behbehani, K., & Ahmad, R. (2015). Obesity Is a Positive Modulator of IL-6R and IL-6 Expression in the Subcutaneous Adipose Tissue: Significance for Metabolic Inflammation. PLoS ONE, 10. https://doi.org/10.1371/journal.pone.0133494.
(21) Xiao, J., Wang, Y., Zhang, X., Wang, W., Zhang, Q., Tang, Y., & Yue, S. (2024). Intestinal permeability in human cardiovascular diseases: a systematic review and meta-analysis. Frontiers in Nutrition, 11. https://doi.org/10.3389/fnut.2024.1361126.
(22) Quirk, A., Schifferer, J., Maki, K., Robinson, A., & Keirns, B. (2025). Biomarkers of Intestinal Permeability are Linked to Incident Cardiovascular Diseases and Cardiovascular Events: A Review of Prospective Studies.. American journal of physiology. Gastrointestinal and liver physiology. https://doi.org/10.1152/ajpgi.00120.2025.
(23) Soler, A., Miller, R., Laughlin, K., Carp, N., Klurfeld, D., & Mullin, J. (1999). Increased tight junctional permeability is associated with the development of colon cancer.. Carcinogenesis, 20 8, 1425-31 . https://doi.org/10.1093/CARCIN/20.8.1425.
(24) Yu, L. (2018). Microbiota dysbiosis and barrier dysfunction in inflammatory bowel disease and colorectal cancers: exploring a common ground hypothesis. Journal of Biomedical Science, 25. https://doi.org/10.1186/s12929-018-0483-8.
(25) Marino, M., Mignozzi, S., Michels, K. B., Cintolo, M., Penagini, R., Gargari, G., Ciafardini, C., Ferraroni, M., Patel, L., Del Bo', C., Leone, P., Airoldi, A., Vecchi, M., Bonzi, R., Oreggia, B., Carnevali, P., Vangeli, M., Mutignani, M., Guglielmetti, S., Riso, P., … Rossi, M. (2024). Serum zonulin and colorectal cancer risk. Scientific reports, 14(1), 28171. https://doi.org/10.1038/s41598-024-76697-z
(26) Song, M., Chan, A. T., & Sun, J. (2020). Influence of the Gut Microbiome, Diet, and Environment on Risk of Colorectal Cancer. Gastroenterology, 158(2), 322–340. https://doi.org/10.1053/j.gastro.2019.06.048
(27) Seethaler, B., Basrai, M., Neyrinck, A. M., Nazare, J. A., Walter, J., Delzenne, N. M., & Bischoff, S. C. (2021). Biomarkers for assessment of intestinal permeability in clinical practice. American journal of physiology. Gastrointestinal and liver physiology, 321(1), G11–G17. https://doi.org/10.1152/ajpgi.00113.2021
(28) Ajamian, M., Steer, D., Rosella, G., & Gibson, P. (2019). Serum zonulin as a marker of intestinal mucosal barrier function: May not be what it seems. PLoS ONE, 14. https://doi.org/10.1371/journal.pone.0210728.
(29) Vanuytsel, T., Tack, J., & Farre, R. (2021). The Role of Intestinal Permeability in Gastrointestinal Disorders and Current Methods of Evaluation. Frontiers in nutrition, 8, 717925. https://doi.org/10.3389/fnut.2021.717925
(30) Scheffler, L., Crane, A., Heyne, H., Tönjes, A., Schleinitz, D., Ihling, C. H., Stumvoll, M., Freire, R., Fiorentino, M., Fasano, A., Kovacs, P., & Heiker, J. T. (2018). Widely Used Commercial ELISA Does Not Detect Precursor of Haptoglobin2, but Recognizes Properdin as a Potential Second Member of the Zonulin Family. Frontiers in endocrinology, 9, 22. https://doi.org/10.3389/fendo.2018.00022
(31) Seethaler, B., Basrai, M., Neyrinck, A., Nazare, J., Walter, J., Delzenne, N., & Bischoff, S. (2021). Biomarkers for assessment of intestinal permeability in clinical practice.. American journal of physiology. Gastrointestinal and liver physiology. https://doi.org/10.1152/ajpgi.00113.2021.
(32) Reiberger, T., Ferlitsch, A., Payer, B., Mandorfer, M., Heinisch, B., Hayden, H., Lammert, F., Trauner, M., Peck‐Radosavljevic, M., & Vogelsang, H. (2013). Non-selective betablocker therapy decreases intestinal permeability and serum levels of LBP and IL-6 in patients with cirrhosis.. Journal of hepatology, 58 5, 911-21 . https://doi.org/10.1016/j.jhep.2012.12.011.
(33) Tibble, J., & Bjarnason, I. (2001). Non-invasive investigation of inflammatory bowel disease.. World journal of gastroenterology, 7 4, 460-5 . https://doi.org/10.3748/WJG.V7.I4.460.
(34) Tibble, J., Sigthorsson, G., Bridger, S., Fagerhol, M., & Bjarnason, I. (2000). Surrogate markers of intestinal inflammation are predictive of relapse in patients with inflammatory bowel disease.. Gastroenterology, 119 1, 15-22 . https://doi.org/10.1053/GAST.2000.8523.
(35) Sikora, M., Stec, A., Chrabaszcz, M., Waśkiel-Burnat, A., Zaremba, M., Olszewska, M., & Rudnicka, L. (2019). Intestinal Fatty Acid Binding Protein, a Biomarker of Intestinal Barrier, is Associated with Severity of Psoriasis. Journal of Clinical Medicine, 8. https://doi.org/10.3390/jcm8071021.
(36) Wang, Y., Ding, L., Yang, J., Liu, L., & Dong, L. (2021). Intestinal fatty acid-binding protein, a biomarker of intestinal barrier dysfunction, increases with the progression of type 2 diabetes. PeerJ, 9. https://doi.org/10.7717/peerj.10800.
(37) Vanuytsel, T., Van Wanrooy, S., Vanheel, H., Vanormelingen, C., Verschueren, S., Houben, E., Rasoel, S., Tόth, J., Holvoet, L., Farré, R., Van Oudenhove, L., Boeckxstaens, G., Verbeke, K., & Tack, J. (2013). Psychological stress and corticotropin-releasing hormone increase intestinal permeability in humans by a mast cell-dependent mechanism. Gut, 63, 1293 - 1299. https://doi.org/10.1136/gutjnl-2013-305690.
(38) Gerdin, L., González-Castro, A., Ericson, A., Persborn, M., Santos, J., Walter, S., Keita, Å., Vicario, M., & Söderholm, J. (2022). Acute psychological stress increases paracellular permeability and modulates immune activity in rectal mucosa of healthy volunteers. United European Gastroenterology Journal, 11, 31 - 41. https://doi.org/10.1002/ueg2.12329.
(39) La Torre, D., Van Oudenhove, L., Vanuytsel, T., & Verbeke, K. (2023). Psychosocial stress-induced intestinal permeability in healthy humans: What is the evidence?. Neurobiology of Stress, 27. https://doi.org/10.1016/j.ynstr.2023.100579.
(40) Ribeiro, F., Petriz, B., Marques, G., Kamilla, L., & Franco, O. (2021). Is There an Exercise-Intensity Threshold Capable of Avoiding the Leaky Gut?. Frontiers in Nutrition, 8. https://doi.org/10.3389/fnut.2021.627289.
(41) March, D., Marchbank, T., Playford, R., Jones, A., Thatcher, R., & Davison, G. (2017). Intestinal fatty acid-binding protein and gut permeability responses to exercise. European Journal of Applied Physiology, 117, 931 - 941. https://doi.org/10.1007/s00421-017-3582-4.
(42) Chantler, S., Griffiths, A., Matu, J., Davison, G., Jones, B., & Deighton, K. (2021). The Effects of Exercise on Indirect Markers of Gut Damage and Permeability: A Systematic Review and Meta-analysis. Sports medicine (Auckland, N.Z.), 51(1), 113–124. https://doi.org/10.1007/s40279-020-01348-y
(43) Stärkel, P., Leclercq, S., de Timary, P., & Schnabl, B. (2018). Intestinal dysbiosis and permeability: the yin and yang in alcohol dependence and alcoholic liver disease. Clinical science (London, England : 1979), 132(2), 199–212. https://doi.org/10.1042/CS20171055
(44) Leclercq, S., Matamoros, S., Cani, P., Neyrinck, A., Jamar, F., Stärkel, P., Windey, K., Tremaroli, V., Bäckhed, F., Verbeke, K., De Timary, P., & Delzenne, N. (2014). Intestinal permeability, gut-bacterial dysbiosis, and behavioral markers of alcohol-dependence severity. Proceedings of the National Academy of Sciences, 111, E4485 - E4493. https://doi.org/10.1073/pnas.1415174111.
(45) Zuo, L., Li, Y., Wang, H., Wu, R., Zhu, W., Zhang, W., Cao, L., Gu, L., Gong, J., Li, N., & Li, J. (2014). Cigarette smoking is associated with intestinal barrier dysfunction in the small intestine but not in the large intestine of mice.. Journal of Crohn's & colitis, 8 12, 1710-22 . https://doi.org/10.1016/j.crohns.2014.08.008.
(46) Schulzke, J., Ploeger, S., Amasheh, M., Fromm, A., Zeissig, S., Troeger, H., Richter, J., Bojarski, C., Schumann, M., & Fromm, M. (2009). Epithelial Tight Junctions in Intestinal Inflammation. Annals of the New York Academy of Sciences, 1165. https://doi.org/10.1111/j.1749-6632.2009.04062.x.
(47) Landy, J., Ronde, E., English, N., Clark, S., Hart, A., Knight, S., Ciclitira, P., & Al-Hassi, H. (2016). Tight junctions in inflammatory bowel diseases and inflammatory bowel disease associated colorectal cancer.. World journal of gastroenterology, 22 11, 3117-26 . https://doi.org/10.3748/wjg.v22.i11.3117.
(48) Crawford, C. K., Lopez Cervantes, V., Quilici, M. L., Armién, A. G., Questa, M., Matloob, M. S., Huynh, L. D., Beltran, A., Karchemskiy, S. J., Crakes, K. R., & Kol, A. (2022). Inflammatory cytokines directly disrupt the bovine intestinal epithelial barrier. Scientific reports, 12(1), 14578. https://doi.org/10.1038/s41598-022-18771-y
(49) Keirns, B. H., Medlin, A. R., Maki, K. A., McClanahan, K., Fruit, S. E., Sciarrillo, C. M., Hart, S. M., Joyce, J., Lucas, E. A., & Emerson, S. R. (2024). Biomarkers of intestinal permeability are associated with inflammation in metabolically healthy obesity but not normal-weight obesity. American journal of physiology. Heart and circulatory physiology, 327(5), H1135–H1145. https://doi.org/10.1152/ajpheart.00381.2024
(50) Hoshiko, H., Feskens, E. J. M., Oosterink, E., Ariens, R. M. C., Mes, J. J., & de Wit, N. J. W. (2021). Identification of leaky gut-related markers as indicators of metabolic health in Dutch adults: The Nutrition Questionnaires plus (NQplus) study. PloS one, 16(6), e0252936. https://doi.org/10.1371/journal.pone.0252936
(51) Di Vincenzo, F., Del Gaudio, A., Petito, V., Lopetuso, L., & Scaldaferri, F. (2023). Gut microbiota, intestinal permeability, and systemic inflammation: a narrative review. Internal and Emergency Medicine, 19, 275 - 293. https://doi.org/10.1007/s11739-023-03374-w.
(52) Kinashi, Y., & Hase, K. (2021). Partners in Leaky Gut Syndrome: Intestinal Dysbiosis and Autoimmunity. Frontiers in Immunology, 12. https://doi.org/10.3389/fimmu.2021.673708.
(53) Stolfi, C., Maresca, C., Monteleone, G., & Laudisi, F. (2022). Implication of Intestinal Barrier Dysfunction in Gut Dysbiosis and Diseases. Biomedicines, 10. https://doi.org/10.3390/biomedicines10020289.
(54) Durkin, L. A., Childs, C. E., & Calder, P. C. (2021). Omega-3 Polyunsaturated Fatty Acids and the Intestinal Epithelium-A Review. Foods (Basel, Switzerland), 10(1), 199. https://doi.org/10.3390/foods10010199
(55) Seethaler, B., Lehnert, K., Yahiaoui-Doktor, M., Basrai, M., Vetter, W., Kiechle, M., & Bischoff, S. (2023). Omega-3 polyunsaturated fatty acids improve intestinal barrier integrity—albeit to a lesser degree than short-chain fatty acids: an exploratory analysis of the randomized controlled LIBRE trial. European Journal of Nutrition, 62, 2779 - 2791. https://doi.org/10.1007/s00394-023-03172-2.
(56) Vijay, A., Astbury, S., Roy, C., Spector, T., & Valdes, A. (2020). The prebiotic effects of omega-3 fatty acid supplementation: A six-week randomised intervention trial. Gut Microbes, 13, 1 - 11. https://doi.org/10.1080/19490976.2020.1863133.
(57) Costantini, L., Molinari, R., Farinon, B., & Merendino, N. (2017). Impact of Omega-3 Fatty Acids on the Gut Microbiota. International Journal of Molecular Sciences, 18. https://doi.org/10.3390/ijms18122645.
(58) Guerbette, T., Rioux, V., Bostoën, M., Ciesielski, V., Coppens-Exandier, H., Buraud, M., Lan, A., & Boudry, G. (2024). Saturated fatty acids differently affect mitochondrial function and the intestinal epithelial barrier depending on their chain length in the in vitro model of IPEC-J2 enterocytes. Frontiers in Cell and Developmental Biology, 12. https://doi.org/10.3389/fcell.2024.1266842.
(59) Gori, M., Altomare, A., Cocca, S., Solida, E., Ribolsi, M., Carotti, S., Rainer, A., Francesconi, M., Morini, S., Cicala, M., & Guarino, M. (2020). Palmitic Acid Affects Intestinal Epithelial Barrier Integrity and Permeability In Vitro. Antioxidants, 9. https://doi.org/10.3390/antiox9050417.
(60) Cândido, F., Valente, F., Grześkowiak, Ł., Moreira, A., Rocha, D., & Alfenas, R. (2018). Impact of dietary fat on gut microbiota and low-grade systemic inflammation: mechanisms and clinical implications on obesity. International Journal of Food Sciences and Nutrition, 69, 125 - 143. https://doi.org/10.1080/09637486.2017.1343286.
(61) Usuda, H., Okamoto, T., & Wada, K. (2021). Leaky Gut: Effect of Dietary Fiber and Fats on Microbiome and Intestinal Barrier. International Journal of Molecular Sciences, 22. https://doi.org/10.3390/ijms22147613.
(62) Cronin, P., Joyce, S., O’Toole, P., & O'Connor, E. (2021). Dietary Fibre Modulates the Gut Microbiota. Nutrients, 13. https://doi.org/10.3390/nu13051655.
(63) Zhang, Q., Cheng, L., Wang, J., Hao, M., & Che, H. (2021). Antibiotic-Induced Gut Microbiota Dysbiosis Damages the Intestinal Barrier, Increasing Food Allergy in Adult Mice. Nutrients, 13. https://doi.org/10.3390/nu13103315.
(64) Krigul, K., Feeney, R., Wongkuna, S., Aasmets, O., Holmberg, S., Andreson, R., Puértolas-Balint, F., Pantiukh, K., Sootak, L., Org, T., Tenson, T., Org, E., & Schroeder, B. (2024). A history of repeated antibiotic usage leads to microbiota-dependent mucus defects. Gut Microbes, 16. https://doi.org/10.1080/19490976.2024.2377570.
(65) Maier, L., Pruteanu, M., Kuhn, M., Zeller, G., Telzerow, A., Anderson, E., Brochado, A., Fernandez, K., Dose, H., Mori, H., Patil, K., Bork, P., & Typas, A. (2018). Extensive impact of non-antibiotic drugs on human gut bacteria. Nature, 555, 623 - 628. https://doi.org/10.1038/nature25979.
(66) Bjarnason, I., Williams, P., Smethurst, P., Peters, T., & Levi, A. (1986). Effect of non-steroidal anti-inflammatory drugs and prostaglandins on the permeability of the human small intestine.. Gut, 27, 1292 - 1297. https://doi.org/10.1136/gut.27.11.1292.
(67) Utzeri, E., & Usai, P. (2017). Role of non-steroidal anti-inflammatory drugs on intestinal permeability and nonalcoholic fatty liver disease. World Journal of Gastroenterology, 23, 3954 - 3963. https://doi.org/10.3748/wjg.v23.i22.3954.
(68) Liu, T., Wang, C., Wang, Y., Wang, L., Ojo, O., Feng, Q., Jiang, X., & Wang, X. (2021). The effect of dietary fiber on gut barrier function, gut microbiota, short-chain fatty acids, inflammation and clinical outcomes in critically ill patients: A systematic review and meta-analysis.. JPEN. Journal of parenteral and enteral nutrition. https://doi.org/10.1002/jpen.2319.
(69) Krawczyk, M., Maciejewska, D., Ryterska, K., Czerwińka-Rogowska, M., Jamioł-Milc, D., Skonieczna-Żydecka, K., Milkiewicz, P., Raszeja-Wyszomirska, J., & Stachowska, E. (2018). Gut Permeability Might be Improved by Dietary Fiber in Individuals with Nonalcoholic Fatty Liver Disease (NAFLD) Undergoing Weight Reduction. Nutrients, 10. https://doi.org/10.3390/nu10111793.
(70) So, D., Whelan, K., Rossi, M., Morrison, M., Holtmann, G., Kelly, J., Shanahan, E., Staudacher, H., & Campbell, K. (2018). Dietary fiber intervention on gut microbiota composition in healthy adults: a systematic review and meta-analysis.. The American journal of clinical nutrition, 107 6, 965-983 . https://doi.org/10.1093/ajcn/nqy041.
(71) Zheng, Y., Zhang, Z., Tang, P., Wu, Y., Zhang, A., Li, D., Wang, C., Wan, J., Yao, H., & Yuan, C. (2023). Probiotics fortify intestinal barrier function: a systematic review and meta-analysis of randomized trials. Frontiers in Immunology, 14. https://doi.org/10.3389/fimmu.2023.1143548.
(72) DiMattia, Z., Damani, J. J., Van Syoc, E., & Rogers, C. J. (2024). Effect of Probiotic Supplementation on Intestinal Permeability in Overweight and Obesity: A Systematic Review of Randomized Controlled Trials and Animal Studies. Advances in nutrition (Bethesda, Md.), 15(1), 100162. https://doi.org/10.1016/j.advnut.2023.100162
(73) Feng, Y., Wang, Y., Wang, P., Huang, Y., & Wang, F. (2018). Short-Chain Fatty Acids Manifest Stimulative and Protective Effects on Intestinal Barrier Function Through the Inhibition of NLRP3 Inflammasome and Autophagy. Cellular Physiology and Biochemistry, 49, 190 - 205. https://doi.org/10.1159/000492853.
(74) Saleri, R., Borghetti, P., Ravanetti, F., Cavalli, V., Ferrari, L., De Angelis, E., Andrani, M., & Martelli, P. (2022). Effects of different short-chain fatty acids (SCFA) on gene expression of proteins involved in barrier function in IPEC-J2. Porcine Health Management, 8. https://doi.org/10.1186/s40813-022-00264-z.
(75) Diao, H., Jiao, A., Yu, B., Mao, X., & Chen, D. (2019). Gastric infusion of short-chain fatty acids can improve intestinal barrier function in weaned piglets. Genes & Nutrition, 14. https://doi.org/10.1186/s12263-019-0626-x.
(76) Fusco, W., Lorenzo, M., Cintoni, M., Porcari, S., Rinninella, E., Kaitsas, F., Lener, E., Mele, M., Gasbarrini, A., Collado, M., Cammarota, G., & Ianiro, G. (2023). Short-Chain Fatty-Acid-Producing Bacteria: Key Components of the Human Gut Microbiota. Nutrients, 15. https://doi.org/10.3390/nu15092211.
(77) Abbasi, F., Lari, M., Khosravi, G., Mansouri, E., Payandeh, N., & Milajerdi, A. (2024). A systematic review and meta-analysis of clinical trials on the effects of glutamine supplementation on gut permeability in adults. Amino Acids, 56. https://doi.org/10.1007/s00726-024-03420-7.
(78) Aleman, R. S., Moncada, M., & Aryana, K. J. (2023). Leaky Gut and the Ingredients That Help Treat It: A Review. Molecules (Basel, Switzerland), 28(2), 619. https://doi.org/10.3390/molecules28020619
(79) Varghese, S., Rao, S., Khattak, A., Zamir, F., & Chaari, A. (2024). Physical Exercise and the Gut Microbiome: A Bidirectional Relationship Influencing Health and Performance. Nutrients, 16(21), 3663. https://doi.org/10.3390/nu16213663
(80) Wang, J., Zhang, Q., Xia, J., & Sun, H. (2022). Moderate Treadmill Exercise Modulates Gut Microbiota and Improves Intestinal Barrier in High-Fat-Diet-Induced Obese Mice via the AMPK/CDX2 Signaling Pathway. Diabetes, metabolic syndrome and obesity : targets and therapy, 15, 209–223. https://doi.org/10.2147/DMSO.S346007
(81) Hintikka, J. E., Ahtiainen, J. P., Permi, P., Jalkanen, S., Lehtonen, M., & Pekkala, S. (2023). Aerobic exercise training and gut microbiome-associated metabolic shifts in women with overweight: a multi-omic study. Scientific reports, 13(1), 11228. https://doi.org/10.1038/s41598-023-38357-6
_edited.jpg)



Commentaires